Mekanika statistika adalah aplikasi teori probabilitas, yang memasukkan matematika untuk menangani populasi besar, ke bidang mekanika, yang menangani gerakan partikel atau objek yang dikenai suatu gaya. Bidang ini memberikan kerangka untuk menghubungkan sifat mikroskopis atom dan molekul individu dengan sifat makroskopis atau limbak (bulk) materi yang diamati sehari-hari, dan menjelaskan termodinamika sebagai produk alami dari statistika dan mekanika
(klasik dan kuantum) pada tingkat mikroskopis. Mekanika statistika
khususnya dapat digunakan untuk menghitung sifat termodinamika materi
limbak berdasarkan data spektroskopis dari molekul individual.
Kemampuan untuk membuat prediksi makroskopis berdasarkan sifat mikroskopis merupakan kelebihan utama mekanika statistika terhadap termodinamika. Kedua teori diatur oleh hukum kedua termodinamika melalui media entropi. Meskipun demikian, entropi dalam termodinamika hanya dapat diketahui secara empiris, sedangkan dalam mekanika statistika, entropi merupakan fungsi distribusi sistem pada kondisi mikro.
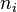 adalah jumlah partikel yang terdapat pada level i atau jumlah keadaan mikro yang sesuai dengan keadaan makro i;
adalah jumlah partikel yang terdapat pada level i atau jumlah keadaan mikro yang sesuai dengan keadaan makro i; 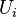 adalah energi i; T adalah temperatur; dan
adalah energi i; T adalah temperatur; dan 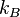 adalah konstanta Boltzmann.
adalah konstanta Boltzmann.
Jika N adalah jumlah total partikel atau keadaan, distribusi kerapatan probabilitas:
Di tahun 1859, Setelah membaca sebuah tulisan tentang difusi molekul oleh Rudolf Clausius, fisikawan Skotlandia James Clerk Maxwell merumuskan sebuah teori yang disebut dengan distribusi Maxwell (Maxwell distribution) dari kecepatan sebuah molekul. Teori ini berisi tentang molekul dengan jumlah tertentu akan memiliki kecepatan tertentu dengan kisaran tertentu pula, hasil ini sekaligus dijadikan sebagai hukum yang pertama statistik didalam fisika. Lima tahun kemudian (1864), Seorang mahasiswa muda dari Vienna bernama Ludwig Boltzmann menghabiskan sebagian besar hidupnya untuk mengembangkan teori distribusi Masxwell (setelah membaca tulisan-tulisan dari Maxwell).
Hasil diatas, digunakan sebagai dasar-dasar termdinamika statistik yang diperkenalkan pada akhir 1800-an oleh Maxwell, Boltzmann, Max Planck, Clausius, and Josiah Willard Gibbs yang menjelaskan dan juga menerapkan teori atom statistik dan kuantum untuk sistem gas ideal. Dimana Maxwell dan Boltzmann merupakan penggagas awal, dan juga mencapai sebuah kesimpulan yang sama mengenai sifat statistik dari sistem gas ideal. Salahsatu sumbangsih dari Boltzmann ("ayah" termodinamika statistik) ialah penurunannya tentang Entropi (S) dan multiplisitas (Ω), penjelasan tentang jumlah kedaan mikroskopis (microstates) menghasilkan keadaan makroskopik (macrostate) yang saling bersesuaian untuk sistem tertentu.
Postulat dasar ini diperlukan karena memungkinkan seseorang untuk menyimpulkan bahwa sistem berada dalam kesetimbangan, keadaan makro merupakan dampak dari kumpulan jumlah keadaan mikro yang sering muncul dan juga keadaan makro yang memiliki peluang terbesar dari suatu sistem.
Postulat dasar ini dibenarkan sebagian, untuk sistem klasik, Teorema Liouville (Hamilton) menyatakan bahwa jika distribusi sistem poin melalui ruang fase diakses adalah seragam pada beberapa waktu, tetap begitu pada waktu setelahnya. Pembenaran yang serupa untuk sistem diskrit dijelaskan dalam mekanisme keseimbangan rinci. Hal ini memungkinkan untuk mendefinisikan fungsi informasi (dalam konteks teori informasi):
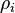 )adalah
sama, I adalah maksimal, dan kita memiliki informasi yang minimal
tentang sistem tersebut. Ketika informasi yang kita miliki maksimal
(yaitu, satu rho sama dengan satu dan sisanya ke nol, sehingga kita
mengetahui keadaan yang ada di dalam sistem), fungsi ini merupakan
fungsi minimal.
)adalah
sama, I adalah maksimal, dan kita memiliki informasi yang minimal
tentang sistem tersebut. Ketika informasi yang kita miliki maksimal
(yaitu, satu rho sama dengan satu dan sisanya ke nol, sehingga kita
mengetahui keadaan yang ada di dalam sistem), fungsi ini merupakan
fungsi minimal.
Fungsi informasi ini sama dengan fungsi pengurangan entropi dalam termodinamika. Mark Srednicki berpendapat bahwa postulat dasar dapat diturunkan hanya dengan dugaan Berry (nama belakang Michael Berry) berlaku untuk sistem yang bersangkutan. [2][3] Dugaan Berry dipercaya hanya untuk sistem yang kacau, dan mengatakan bahwa energi dalam keadaan nilai eigen didistribusikan sebagai variabel bebas Gaussian. Semua sistem realistis dengan lebih dari beberapa derajat kebebasan diharapkan menjadi sistem yang kacau, hal ini menempatkan postulat dasar ini sebagai pijakan. Dugaan Berry juga ditampilkan setara dengan teori informasi prinsip bias minimal. [4]
Tiap Ansambel terkait dengan partition function, dengan manipulasi matematis, dapat digunakan untuk mendapatkan nilai-nilai dari sifat termodinamika suatu sistem. Menurut hubungan sistem untuk seluruh alam semesta, salah satu dari tiga jenis ansambel yang sudah ada mungkin berlaku, denagn tujuan untuk meningkatkan kompleksivitas.
entropi suatu sistem memiliki kecenderungan untuk terus meningkat, sehingga entropi maksimum akan bergantung pada kesetimbangan termodinamika dalam sistem.
Karena sebuah sistem yang terisolasi memiliki energi yang konstan, total energi dari sistem tidak mengalami fluktuasi. Dengan demikian, sistem hanya dapat mengakses dari keadaan mikrostate yang sesuai dengan nilai yang diberikan Esuatu energi. Energi internal sistem ini kemudian akan sama dengan energi sistem.
Mari kita sebut jumlah keadaan mikrostate yang menyatakan nilai energi pada sistem.
Keadaan makroskopik entropi maksimal untuk sistem adalah keadaan di mana
semua keadaan mikrostate sama-sama mungkin terjadi, dengan probabilitas
jumlah keadaan mikrostate yang menyatakan nilai energi pada sistem.
Keadaan makroskopik entropi maksimal untuk sistem adalah keadaan di mana
semua keadaan mikrostate sama-sama mungkin terjadi, dengan probabilitas
 , selama fluktuasi sistem.
, selama fluktuasi sistem.
 bahwa sistem makroskopik di kesetimbangan termal dengan lingkungannya, akan berada dalam microstate diberikan dengan energi
bahwa sistem makroskopik di kesetimbangan termal dengan lingkungannya, akan berada dalam microstate diberikan dengan energi  sesuai dengan distribusi Boltzmann :
sesuai dengan distribusi Boltzmann :
 timbul dari kenyataan bahwa sistem berada dalam kesetimbangan termal
dengan lingkungannya. Probabilitas dari berbagai microstates harus
ditambah satu, dan faktor normalisasi sebagai penyebut adalah kanonik fungsi partisi:
timbul dari kenyataan bahwa sistem berada dalam kesetimbangan termal
dengan lingkungannya. Probabilitas dari berbagai microstates harus
ditambah satu, dan faktor normalisasi sebagai penyebut adalah kanonik fungsi partisi:
 adalah energi
adalah energi 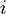 dari mikrostate ke sistem. Fungsi partisi adalah ukuran dari jumlah
mikrostate yang masuk ke dalam sistem pada suhu tertentu. Artikel kanonik ansambel berisi turunan dari faktor Boltzmann dan bentuk fungsi partisi dari prinsip pertama.
dari mikrostate ke sistem. Fungsi partisi adalah ukuran dari jumlah
mikrostate yang masuk ke dalam sistem pada suhu tertentu. Artikel kanonik ansambel berisi turunan dari faktor Boltzmann dan bentuk fungsi partisi dari prinsip pertama.
Singkatnya, probabilitas untuk menemukan sebuah sistem pada suhu dalam keadaan tertentu dengan energi
dalam keadaan tertentu dengan energi  adalah
adalah
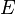 adalahtertafsirkan dan ditafsirkan sebagai definisi mikroskopis dari variabel energi dalam termodinamika
adalahtertafsirkan dan ditafsirkan sebagai definisi mikroskopis dari variabel energi dalam termodinamika  , dan dapat diperoleh dengan mengambil turunan dari fungsi partisi terhadap suhu. sehingga:
, dan dapat diperoleh dengan mengambil turunan dari fungsi partisi terhadap suhu. sehingga:
 as
as  , the following microscopic definition of internal energy:
, the following microscopic definition of internal energy:
 (energi dalam),
(energi dalam), 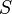 (entropi) dan
(entropi) dan  (energi bebas) sudah cukup untuk menurunkan ekspresi untuk jumlah
termodinamika lainnya. Strategi paling sederhana adalah sebagai berikut.
Mungkin ada kuantitas intensif atau ekstensif yang masuk secara
eksplisit dalam ekspresi untuk energi mikroskopis
(energi bebas) sudah cukup untuk menurunkan ekspresi untuk jumlah
termodinamika lainnya. Strategi paling sederhana adalah sebagai berikut.
Mungkin ada kuantitas intensif atau ekstensif yang masuk secara
eksplisit dalam ekspresi untuk energi mikroskopis  ,
misalnya untuk bidang magnetik (intensif) atau volume (luas). Kemudian,
variabel termodinamika konjugasi adalah turunan dari energi internal.
Magnetisasi makroskopik (luas) adalah turunan dari
,
misalnya untuk bidang magnetik (intensif) atau volume (luas). Kemudian,
variabel termodinamika konjugasi adalah turunan dari energi internal.
Magnetisasi makroskopik (luas) adalah turunan dari  terhadap bidang (intensif) magnet, dan tekanan (intensif) adalah turunan dari
terhadap bidang (intensif) magnet, dan tekanan (intensif) adalah turunan dari  sebanding volume (luas).
sebanding volume (luas).
Perlakuan dalam bagian ini mengasumsikan tidak ada pertukaran materi (yaitu massa tetap dan nomor partikel tetap). Namun, volume sistem adalah variabel yang berarti kepadatan juga adalah variabel.
Probabilitas ini dapat digunakan untuk mencari nilai rata-rata, yang sesuai dengan nilai makroskopik, properti apapun, , yang tergantung pada keadaan energetik dari sistem dengan menggunakan rumus:
, yang tergantung pada keadaan energetik dari sistem dengan menggunakan rumus:
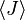 adlah rata-rata dari nilai
adlah rata-rata dari nilai  . Persamaan ini dapat digunakan untuk energy dalam,
. Persamaan ini dapat digunakan untuk energy dalam,  :
:
 dan
dan 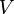 untuk sampai pada ekspresi untuk tekanan dalam hal suhu saja, volume
dan fungsi partisi. Hubungan serupa dalam hal fungsi partisi dapat
diturunkan untuk sifat termodinamika lainnya seperti yang ditunjukkan
pada tabel berikut, lihat juga penjelasan rinci di 28statistical_mechanics% 29 konfigurasi terpisahkan.
untuk sampai pada ekspresi untuk tekanan dalam hal suhu saja, volume
dan fungsi partisi. Hubungan serupa dalam hal fungsi partisi dapat
diturunkan untuk sifat termodinamika lainnya seperti yang ditunjukkan
pada tabel berikut, lihat juga penjelasan rinci di 28statistical_mechanics% 29 konfigurasi terpisahkan.
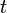 ,
,  ,
,  ,
,  ,
,  , dan
, dan  sesuai dengan translasi, configurational, nuklir, mode elektronik,
rotasi dan vibrasi, masing-masing. Hubungan dalam persamaan ini dapat
disubstitusikan ke persamaan pertama untuk memberikan:
sesuai dengan translasi, configurational, nuklir, mode elektronik,
rotasi dan vibrasi, masing-masing. Hubungan dalam persamaan ini dapat
disubstitusikan ke persamaan pertama untuk memberikan:
Ekspresi untuk fungsi partisi berbagai molekul ditunjukkan pada tabel berikut.
Persamaan ini dapat dikombinasikan dengan yang di tabel pertama untuk
menentukan kontribusi dari modus energi tertentu ke properti
termodinamika. Misalnya "tekanan rotasi" dapat ditentukan dengan cara
ini. Tekanan total dapat ditemukan dengan menjumlahkan kontribusi
tekanan dari semua mode individu, yaitu:
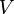 ,
,  dan potensi kimia adalah tetap. Jika sistem yang diteliti adalah sistem terbuka (di mana materi dapat ditukar), tetapi jumlah partikel tidak kekal, kita harus memperkenalkan kimia potensials, μj,j = 1, ..., n dan mengganti kanonik fungsi partisi dengan besar fungsi partisi kanonik:
dan potensi kimia adalah tetap. Jika sistem yang diteliti adalah sistem terbuka (di mana materi dapat ditukar), tetapi jumlah partikel tidak kekal, kita harus memperkenalkan kimia potensials, μj,j = 1, ..., n dan mengganti kanonik fungsi partisi dengan besar fungsi partisi kanonik:
Mari kita ulang semuanya menggunakan ansambel kanonik besar saat ini. Volume yang tersisa tetap dan tidak mencari di sama sekali dalam perawatan ini. Seperti sebelumnya,j adalah indeks untuk partikel-partikel dari spesies j dan i adalah indeks untuk microstate i:
Dalam ansambel mikro-kanonik, pertukaran sistem ada energi dengan dunia luar, dan karena itu tidak tergantung pada fluktuasi energi; dalam ansambel kanonik, sistem ini bebas untuk bertukar energi dengan luar dalam bentuk panas .
Dalam [batas [termodinamika]], yang merupakan batas dari sistem yang besar, fluktuasi menjadi diabaikan, sehingga semua penjelasan ini bertemu dengan deskripsi yang sama. Dengan kata lain, perilaku makroskopik sistem tidak bergantung pada ansambel khusus digunakan untuk deskripsinya.
Mengingat pertimbangan-pertimbangan ini, ansambel terbaik untuk memilih untuk perhitungan sifat-sifat makroskopik sistem adalah bahwa ansambel yang memungkinkan hasil yang akan diperoleh paling mudah.
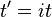 .
.
Mempertimbangkan sebuah masalah kecil, jalan bergerak sepanjang jalur 1D dalam arah x. Misalkan jalan bergerak baik jarak + atau - pada jarak tetap b, tergantung pada sisi koin yang dilempar, apakah muncul kepala atau ekor. Mari kita mulai dengan mempertimbangkan statistik dari langkah jalan kecil yang diambil (dimana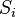 adalah langkah ke-i yang diambil):
adalah langkah ke-i yang diambil):
 . Ini masuk akal, karena jika i = j
maka kita mempertimbangkan langkah yang sama. Sebaliknya secara trivial
maka dapat ditunjukkan bahwa perpindahan rata-rata jalan pada sumbu-x
adalah 0;
. Ini masuk akal, karena jika i = j
maka kita mempertimbangkan langkah yang sama. Sebaliknya secara trivial
maka dapat ditunjukkan bahwa perpindahan rata-rata jalan pada sumbu-x
adalah 0;
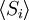 yang dinyatakan adalah 0, maka jumlah dari 0 masih tetap 0. Hal ini
juga dapat ditunjukkan menggunakan metode yang sama seperti yang
ditunjukkan di atas untuk menghitung akar mean nilai kuadrat dari
masalah. Hasil perhitungan ini diberikan di bawah ini:
yang dinyatakan adalah 0, maka jumlah dari 0 masih tetap 0. Hal ini
juga dapat ditunjukkan menggunakan metode yang sama seperti yang
ditunjukkan di atas untuk menghitung akar mean nilai kuadrat dari
masalah. Hasil perhitungan ini diberikan di bawah ini:
Ada dua jenis jalan acak dalam ruang : jalan acak self-avoinding, dimana ikatan antar rantai polimer berinteraksi dan tidak tumpang tindih dalam ruang, dan jalan acak pure (murni), di mana ikatan antar rantai polimer tidak berinteraksi dan ikatan terletak bebas di atas satu sama lain. Jenis pertama adalah yang paling digunakan untuk sistem fisik, tapi larutannya sulit untuk dapat menggunakan prinsip pertama.
Dengan mempertimbangkan sebuah hubungan secara bebas, rantai polimer yang tidak berinteraksi, vektor end-to-end adalah dimana
dimana  adalah posisi vektor dari ikatan ke-i dalam rantai. Sebagai hasil dari teorema limit pusat, jika N >> 1 kemudian kita anggap distribusi Gaussian untuk vektor end-to-end. Kita dapat membuat pernyataan statistik dari ikatan itu sendiri;
adalah posisi vektor dari ikatan ke-i dalam rantai. Sebagai hasil dari teorema limit pusat, jika N >> 1 kemudian kita anggap distribusi Gaussian untuk vektor end-to-end. Kita dapat membuat pernyataan statistik dari ikatan itu sendiri;
 ;oleh isotropi ruang
;oleh isotropi ruang
 ;semua ikatan dalam rantai tersebut tidak berkorelasi satu sama lain
;semua ikatan dalam rantai tersebut tidak berkorelasi satu sama lain
Menggunakan statistik dari ikatan individu, maka dengan mudah menunjukkan bahwa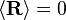 dan
dan  .
Perhatikan hasil terakhir adalah sama dengan yang ditemukan jalan acak
pada waktunya. Dengan asumsi seperti yang telah dinyatakan, bahwa
distribusi vektor end-to-end untuk jumlah yang sangat besar dari rantai
polimer yang identik gaussian, distribusi probabilitas memiliki bentuk
sebagai berikut:
.
Perhatikan hasil terakhir adalah sama dengan yang ditemukan jalan acak
pada waktunya. Dengan asumsi seperti yang telah dinyatakan, bahwa
distribusi vektor end-to-end untuk jumlah yang sangat besar dari rantai
polimer yang identik gaussian, distribusi probabilitas memiliki bentuk
sebagai berikut:
 .
Secara fisik jumlah ini, microstates yang memiliki vektor end-to-end
dari 0 lebih baik daripada microstate lainnya. Sekarang dengan
mempertimbangkan
.
Secara fisik jumlah ini, microstates yang memiliki vektor end-to-end
dari 0 lebih baik daripada microstate lainnya. Sekarang dengan
mempertimbangkan
dimana F adalah energi bebas Helmholtz , adalah trivial untuk menunjukkan bahwa
Sebuah pegas hooke!
Hasil ini dikenal sebagai entropic spring result dan jumlah adalah setelah peregangan (stretching) rantai polimer anda melakukan kerja pada sistem untuk menariknya (lebih disukai) dari keadaan kesetimbangannya. Contoh yang umum adalah pita elastis, terdiri dari polimer rantai panjang (karet). Dengan peregangan (stretching) pita elastis anda melakukan kerja pada sistem dan pita berperilaku seperti semi konvensional, kecuali tidak seperti halnya semi logam, semua kerja yang dilakukan muncul sebagai energi termal, banyak dalam kasus termodinamika seperti mengompresi gas ideal dalam piston. Mungkin pada awalnya akan mengejutkan bahwa kerja yang dilakukan pada peregangan (stretching) rantai polimer dapat berhubungan sepenuhnya untuk perubahan entropi dari sistem sebagai akibat dari peregangan (stretching). Namun, ini adalah karakteristik dari sistem yang tidak menyimpan energi apapun sebagai energi potensial, seperti gas ideal. Bahwa sistem tersebut sepenuhnya didorong oleh perubahan entropi pada suhu tertentu, bisa dilihat ketika sebuah kasus yang boleh melakukan kerja pada lingkungan sekitarnya (seperti ketika sebuah pita elastis melakukan kerja pada lingkungan dengan kontraktor, atau gas ideal melakukan kerja pada lingkungan dengan memperluas). Karena perubahan energi bebas dalam kasus tersebut berasal sepenuhnya dari perubahan entropi bukan internal (potensial) konversi energi, dalam kasus kerja, keduanya dapat ditarik seluruhnya dari energi termal dalam polimer, dengan efisiensi 100% dari konversi untuk energi termal untuk kerja . pada gas ideal dan polimer, hal ini dimungkinkan oleh kenaikan bahan entropi dari kontraksi yang membuat hilangnya entropi dari penyerapan energi panas, dan pendinginan material.
Dalam sebuah sistem yang dibatasi, karakteristik terpenting unit-unit mikroskopik ini yaitu energi-energinya yang terkuantisasi. Hal tersebut dimana energi dapat menjadi sebuah sistem makroskopik membentuk sebuah kontinum virtual dari banyak kemungkinan, energi-energi tersebut terbuka terhadap berbagai komponen-komponen submikroskopik yang terbatas untuk satu set diskontinu dari alternatif yang terhubung dengan nilai-nilai integral dari beberapa bilangan kuantum.
Kemampuan untuk membuat prediksi makroskopis berdasarkan sifat mikroskopis merupakan kelebihan utama mekanika statistika terhadap termodinamika. Kedua teori diatur oleh hukum kedua termodinamika melalui media entropi. Meskipun demikian, entropi dalam termodinamika hanya dapat diketahui secara empiris, sedangkan dalam mekanika statistika, entropi merupakan fungsi distribusi sistem pada kondisi mikro.
Pendahuluan
Masalah mendasar Termodinamika Statistik adalah untuk menghitung sejumlah distribusi energi yang diberikan E dari N pada sistem yang identik.[1] Tujuan Termodinamika Statistik adalah untuk memahami dan menginterpretasikan sifat makroskopik yang terukur berdasarkan sifat-sifat partikel penyusunnya dan interaksi antar partikel penyusun tersebut. Hal ini dilakukan dengan menghubungkan fungsi termodinamika dengan persamaan mekanika kuantum. Dua besaran utama yang digunakan dalam termodinamika statistik adalah Faktor Boltzmann dan Fungsi Partisi.Dasar-Dasar
Topik utama yang tercakup dalam termodinamika statistik meliputi:- Keadaan mikro dan konfigurasi
- Hukum Distribusi Boltzmann
- Fungsi partisi, Integral konfigurasi atau fungsi konfigurasi partisi
- Kesetimbangan termodinamika - termal, mekanik, kimia
- Derajat bebas internal - rotasi, vibrasi, eksitasi elektronik, dll
- Kapasitas Kalor - padatan einstein, gas poliatomik, dll
- Teorema Kalor Nernst
- Fluktuasi
- Paradoks Gibbs
- Degenerasi
- kB adalah konstanta Boltzmann 1.38066×10−23 J K−1 dan
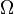 adalah jumlah keadaan mikro sesuai dengan keadaan makro termodinamika yang diamati
adalah jumlah keadaan mikro sesuai dengan keadaan makro termodinamika yang diamati
Distribusi Boltzmann
Jika sistem besar distribusi Boltzmann dapat digunakan (distribusi Boltzmann merupakan hasil perkiraan)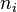 adalah jumlah partikel yang terdapat pada level i atau jumlah keadaan mikro yang sesuai dengan keadaan makro i;
adalah jumlah partikel yang terdapat pada level i atau jumlah keadaan mikro yang sesuai dengan keadaan makro i; 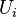 adalah energi i; T adalah temperatur; dan
adalah energi i; T adalah temperatur; dan 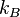 adalah konstanta Boltzmann.
adalah konstanta Boltzmann.Jika N adalah jumlah total partikel atau keadaan, distribusi kerapatan probabilitas:
Sejarah
Pada Tahun 1738, seorang ilmuan Fisika dan Matematika dari Swiss yang bernama Daniel Bernoulli mempublikasi sebuah dasar bagi teori kinetik gas yang disebut dengan Hydrodynamica. Dalam publikasinya ini, Bernouli mengemukakan bahawa gas terdiri dari sejumlah besar molekul yang bergerak secara acak sehingga udara panas yang dapat dirasakan dijelaskan sebagai energi kinetik dari gerakan gas tersebut yang mengenai permukaan kulit kita.Di tahun 1859, Setelah membaca sebuah tulisan tentang difusi molekul oleh Rudolf Clausius, fisikawan Skotlandia James Clerk Maxwell merumuskan sebuah teori yang disebut dengan distribusi Maxwell (Maxwell distribution) dari kecepatan sebuah molekul. Teori ini berisi tentang molekul dengan jumlah tertentu akan memiliki kecepatan tertentu dengan kisaran tertentu pula, hasil ini sekaligus dijadikan sebagai hukum yang pertama statistik didalam fisika. Lima tahun kemudian (1864), Seorang mahasiswa muda dari Vienna bernama Ludwig Boltzmann menghabiskan sebagian besar hidupnya untuk mengembangkan teori distribusi Masxwell (setelah membaca tulisan-tulisan dari Maxwell).
Hasil diatas, digunakan sebagai dasar-dasar termdinamika statistik yang diperkenalkan pada akhir 1800-an oleh Maxwell, Boltzmann, Max Planck, Clausius, and Josiah Willard Gibbs yang menjelaskan dan juga menerapkan teori atom statistik dan kuantum untuk sistem gas ideal. Dimana Maxwell dan Boltzmann merupakan penggagas awal, dan juga mencapai sebuah kesimpulan yang sama mengenai sifat statistik dari sistem gas ideal. Salahsatu sumbangsih dari Boltzmann ("ayah" termodinamika statistik) ialah penurunannya tentang Entropi (S) dan multiplisitas (Ω), penjelasan tentang jumlah kedaan mikroskopis (microstates) menghasilkan keadaan makroskopik (macrostate) yang saling bersesuaian untuk sistem tertentu.
Postulat Dasar
Postulat dasar dalam mekanika statistika (juga dikenal sebagai postulat probabilitas apriori) adalah- Semua keadaan mikro yang mungkin muncul dari suatu sistem terisolasi dalam keadaan keseimbangan memiliki peluang sama.
Postulat dasar ini diperlukan karena memungkinkan seseorang untuk menyimpulkan bahwa sistem berada dalam kesetimbangan, keadaan makro merupakan dampak dari kumpulan jumlah keadaan mikro yang sering muncul dan juga keadaan makro yang memiliki peluang terbesar dari suatu sistem.
Postulat dasar ini dibenarkan sebagian, untuk sistem klasik, Teorema Liouville (Hamilton) menyatakan bahwa jika distribusi sistem poin melalui ruang fase diakses adalah seragam pada beberapa waktu, tetap begitu pada waktu setelahnya. Pembenaran yang serupa untuk sistem diskrit dijelaskan dalam mekanisme keseimbangan rinci. Hal ini memungkinkan untuk mendefinisikan fungsi informasi (dalam konteks teori informasi):
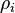 )adalah
sama, I adalah maksimal, dan kita memiliki informasi yang minimal
tentang sistem tersebut. Ketika informasi yang kita miliki maksimal
(yaitu, satu rho sama dengan satu dan sisanya ke nol, sehingga kita
mengetahui keadaan yang ada di dalam sistem), fungsi ini merupakan
fungsi minimal.
)adalah
sama, I adalah maksimal, dan kita memiliki informasi yang minimal
tentang sistem tersebut. Ketika informasi yang kita miliki maksimal
(yaitu, satu rho sama dengan satu dan sisanya ke nol, sehingga kita
mengetahui keadaan yang ada di dalam sistem), fungsi ini merupakan
fungsi minimal.Fungsi informasi ini sama dengan fungsi pengurangan entropi dalam termodinamika. Mark Srednicki berpendapat bahwa postulat dasar dapat diturunkan hanya dengan dugaan Berry (nama belakang Michael Berry) berlaku untuk sistem yang bersangkutan. [2][3] Dugaan Berry dipercaya hanya untuk sistem yang kacau, dan mengatakan bahwa energi dalam keadaan nilai eigen didistribusikan sebagai variabel bebas Gaussian. Semua sistem realistis dengan lebih dari beberapa derajat kebebasan diharapkan menjadi sistem yang kacau, hal ini menempatkan postulat dasar ini sebagai pijakan. Dugaan Berry juga ditampilkan setara dengan teori informasi prinsip bias minimal. [4]
Ensembel Statistika
Perumusan modern mekanika statistik didasarkan pada deskripsi dari sistem fisik oleh sebuah ensemble yang mewakili semua konfigurasi yang mungkin dari sistem dan probabilitas untuk mewujudkan konfigurasi masing-masing.Tiap Ansambel terkait dengan partition function, dengan manipulasi matematis, dapat digunakan untuk mendapatkan nilai-nilai dari sifat termodinamika suatu sistem. Menurut hubungan sistem untuk seluruh alam semesta, salah satu dari tiga jenis ansambel yang sudah ada mungkin berlaku, denagn tujuan untuk meningkatkan kompleksivitas.
- Ansambel Microcanonic: membahas sebuah sistem yang benar-benar terisolasi, memiliki energi yang konstan, karena tidak bertukar energi atau massa dengan seluruh alam semesta.
- Canonic: membahas sebuah sistem dalam kesetimbangan termal dengan lingkungannya. Hanya dapat bertukar energi dalam bentuk panas dengan lingkungan.
- Grand-canonic: Digunakan dalam sistem terbuka yang memungkinkan adanya pertukaran energi dan massa dengan lingkungan.
- Isoterm Isobar : Digunakan ketika sistem berada pada pada suhu dan tekanan tetap.
| Summary of ensembles in statistical mechanics |
Ensembles: | ||
| Microcanonical | Canonical | Grand canonical | |
| Constant variables | E, N, V o B | T, N, V o B | T, μ, V o B |
| Microscopic features | Number of microstates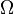 |
Canonical partition function |
Grand canonical partition function |
| Macroscopic function |  |
 |
 |
Ensembel Microcanonic
Dalam ansambel microcanonical, N, V, dan E dalam keadaan tetap. Sejak hukum kedua termodinamika berlaku untuk sistem terisolasi, kasus pertama yang diselidiki akan sesuai dengan kasus ini. Pada intinya ansambel Microcanonical dibahas suatu sistem yang terisolasi.entropi suatu sistem memiliki kecenderungan untuk terus meningkat, sehingga entropi maksimum akan bergantung pada kesetimbangan termodinamika dalam sistem.
Karena sebuah sistem yang terisolasi memiliki energi yang konstan, total energi dari sistem tidak mengalami fluktuasi. Dengan demikian, sistem hanya dapat mengakses dari keadaan mikrostate yang sesuai dengan nilai yang diberikan Esuatu energi. Energi internal sistem ini kemudian akan sama dengan energi sistem.
Mari kita sebut
 jumlah keadaan mikrostate yang menyatakan nilai energi pada sistem.
Keadaan makroskopik entropi maksimal untuk sistem adalah keadaan di mana
semua keadaan mikrostate sama-sama mungkin terjadi, dengan probabilitas
jumlah keadaan mikrostate yang menyatakan nilai energi pada sistem.
Keadaan makroskopik entropi maksimal untuk sistem adalah keadaan di mana
semua keadaan mikrostate sama-sama mungkin terjadi, dengan probabilitas
 , selama fluktuasi sistem.
, selama fluktuasi sistem.-
- dimana
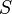 adalah entropi sistem, dan
adalah entropi sistem, dan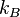 adalah konstanta Boltzmann.
adalah konstanta Boltzmann.
Ensembel Canonic
Dalam N ansambel canonical, V dan T adalah tetap. Meminjam konsep dari ansambel kanonik, adalah mungkin untuk mendapatkan probabilitas bahwa sistem makroskopik di kesetimbangan termal dengan lingkungannya, akan berada dalam microstate diberikan dengan energi
bahwa sistem makroskopik di kesetimbangan termal dengan lingkungannya, akan berada dalam microstate diberikan dengan energi  sesuai dengan distribusi Boltzmann :
sesuai dengan distribusi Boltzmann :- dimana

 timbul dari kenyataan bahwa sistem berada dalam kesetimbangan termal
dengan lingkungannya. Probabilitas dari berbagai microstates harus
ditambah satu, dan faktor normalisasi sebagai penyebut adalah kanonik fungsi partisi:
timbul dari kenyataan bahwa sistem berada dalam kesetimbangan termal
dengan lingkungannya. Probabilitas dari berbagai microstates harus
ditambah satu, dan faktor normalisasi sebagai penyebut adalah kanonik fungsi partisi: adalah energi
adalah energi 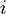 dari mikrostate ke sistem. Fungsi partisi adalah ukuran dari jumlah
mikrostate yang masuk ke dalam sistem pada suhu tertentu. Artikel kanonik ansambel berisi turunan dari faktor Boltzmann dan bentuk fungsi partisi dari prinsip pertama.
dari mikrostate ke sistem. Fungsi partisi adalah ukuran dari jumlah
mikrostate yang masuk ke dalam sistem pada suhu tertentu. Artikel kanonik ansambel berisi turunan dari faktor Boltzmann dan bentuk fungsi partisi dari prinsip pertama.Singkatnya, probabilitas untuk menemukan sebuah sistem pada suhu
 dalam keadaan tertentu dengan energi
dalam keadaan tertentu dengan energi  adalah
adalahHubungan dengan Termodinamika
Fungsi partisi dapat digunakan untuk menemukan nilai (rata-rata) yang diharapkan dari setiap properti mikroskopis dari sistem, yang kemudian dapat dikaitkan dengan variabel makroskopik. Sebagai contoh, nilai ekspektasi dari energi mikroskopis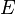 adalahtertafsirkan dan ditafsirkan sebagai definisi mikroskopis dari variabel energi dalam termodinamika
adalahtertafsirkan dan ditafsirkan sebagai definisi mikroskopis dari variabel energi dalam termodinamika  , dan dapat diperoleh dengan mengambil turunan dari fungsi partisi terhadap suhu. sehingga:
, dan dapat diperoleh dengan mengambil turunan dari fungsi partisi terhadap suhu. sehingga: as
as  , the following microscopic definition of internal energy:
, the following microscopic definition of internal energy: i .......
i .......
 (energi dalam),
(energi dalam), 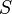 (entropi) dan
(entropi) dan  (energi bebas) sudah cukup untuk menurunkan ekspresi untuk jumlah
termodinamika lainnya. Strategi paling sederhana adalah sebagai berikut.
Mungkin ada kuantitas intensif atau ekstensif yang masuk secara
eksplisit dalam ekspresi untuk energi mikroskopis
(energi bebas) sudah cukup untuk menurunkan ekspresi untuk jumlah
termodinamika lainnya. Strategi paling sederhana adalah sebagai berikut.
Mungkin ada kuantitas intensif atau ekstensif yang masuk secara
eksplisit dalam ekspresi untuk energi mikroskopis  ,
misalnya untuk bidang magnetik (intensif) atau volume (luas). Kemudian,
variabel termodinamika konjugasi adalah turunan dari energi internal.
Magnetisasi makroskopik (luas) adalah turunan dari
,
misalnya untuk bidang magnetik (intensif) atau volume (luas). Kemudian,
variabel termodinamika konjugasi adalah turunan dari energi internal.
Magnetisasi makroskopik (luas) adalah turunan dari  terhadap bidang (intensif) magnet, dan tekanan (intensif) adalah turunan dari
terhadap bidang (intensif) magnet, dan tekanan (intensif) adalah turunan dari  sebanding volume (luas).
sebanding volume (luas).Perlakuan dalam bagian ini mengasumsikan tidak ada pertukaran materi (yaitu massa tetap dan nomor partikel tetap). Namun, volume sistem adalah variabel yang berarti kepadatan juga adalah variabel.
Probabilitas ini dapat digunakan untuk mencari nilai rata-rata, yang sesuai dengan nilai makroskopik, properti apapun,
 , yang tergantung pada keadaan energetik dari sistem dengan menggunakan rumus:
, yang tergantung pada keadaan energetik dari sistem dengan menggunakan rumus: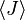 adlah rata-rata dari nilai
adlah rata-rata dari nilai  . Persamaan ini dapat digunakan untuk energy dalam,
. Persamaan ini dapat digunakan untuk energy dalam,  :
: dan
dan 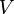 untuk sampai pada ekspresi untuk tekanan dalam hal suhu saja, volume
dan fungsi partisi. Hubungan serupa dalam hal fungsi partisi dapat
diturunkan untuk sifat termodinamika lainnya seperti yang ditunjukkan
pada tabel berikut, lihat juga penjelasan rinci di 28statistical_mechanics% 29 konfigurasi terpisahkan.
untuk sampai pada ekspresi untuk tekanan dalam hal suhu saja, volume
dan fungsi partisi. Hubungan serupa dalam hal fungsi partisi dapat
diturunkan untuk sifat termodinamika lainnya seperti yang ditunjukkan
pada tabel berikut, lihat juga penjelasan rinci di 28statistical_mechanics% 29 konfigurasi terpisahkan.| Helmholtz free energy: | 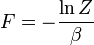 |
|---|---|
| Internal energy: |  |
| Pressure: |  |
| Entropy: |  |
| Gibbs free energy: |  |
| Enthalpy: |  |
| Constant volume heat capacity: |  |
| Constant pressure heat capacity: |  |
| Chemical potential: |  To clarify, this is not a grand canonical ensemble.
Hal ini sering berguna untuk mempertimbangkan energi dari molekul
yang diberikan akan didistribusikan di antara sejumlah mode. Sebagai
contoh, energi translasi mengacu bahwa sebagian dari energi yang
berkaitan dengan gerak pusat massa molekul. Energi Configurational
mengacu bahwa sebagian dari energi yang berkaitan dengan kekuatan
menarik dan menjijikkan berbagai antara molekul dalam suatu sistem.
Modus lain semuanya dianggap internal untuk setiap molekul. Mereka
termasuk rotasi, getaran, mode elektronik dan nuklir. Jika kita
berasumsi bahwa setiap mode adalah independen (asumsi yang
dipertanyakan) total energi dapat dinyatakan sebagai jumlah dari
masing-masing komponen: To clarify, this is not a grand canonical ensemble.
Hal ini sering berguna untuk mempertimbangkan energi dari molekul
yang diberikan akan didistribusikan di antara sejumlah mode. Sebagai
contoh, energi translasi mengacu bahwa sebagian dari energi yang
berkaitan dengan gerak pusat massa molekul. Energi Configurational
mengacu bahwa sebagian dari energi yang berkaitan dengan kekuatan
menarik dan menjijikkan berbagai antara molekul dalam suatu sistem.
Modus lain semuanya dianggap internal untuk setiap molekul. Mereka
termasuk rotasi, getaran, mode elektronik dan nuklir. Jika kita
berasumsi bahwa setiap mode adalah independen (asumsi yang
dipertanyakan) total energi dapat dinyatakan sebagai jumlah dari
masing-masing komponen: |
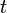 ,
,  ,
,  ,
,  ,
,  , dan
, dan  sesuai dengan translasi, configurational, nuklir, mode elektronik,
rotasi dan vibrasi, masing-masing. Hubungan dalam persamaan ini dapat
disubstitusikan ke persamaan pertama untuk memberikan:
sesuai dengan translasi, configurational, nuklir, mode elektronik,
rotasi dan vibrasi, masing-masing. Hubungan dalam persamaan ini dapat
disubstitusikan ke persamaan pertama untuk memberikan:Ekspresi untuk fungsi partisi berbagai molekul ditunjukkan pada tabel berikut.
| Nuclear |  |
|---|---|
| Electronic |  |
| Vibrational |  |
| Rotational (linear) | 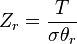 |
| Rotational (non-linear) |  |
| Translational |  |
| Configurational (ideal gas) |  |
Ensembel Grand canonic
Dalam kanonik grand ensemble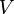 ,
,  dan potensi kimia adalah tetap. Jika sistem yang diteliti adalah sistem terbuka (di mana materi dapat ditukar), tetapi jumlah partikel tidak kekal, kita harus memperkenalkan kimia potensials, μj,j = 1, ..., n dan mengganti kanonik fungsi partisi dengan besar fungsi partisi kanonik:
dan potensi kimia adalah tetap. Jika sistem yang diteliti adalah sistem terbuka (di mana materi dapat ditukar), tetapi jumlah partikel tidak kekal, kita harus memperkenalkan kimia potensials, μj,j = 1, ..., n dan mengganti kanonik fungsi partisi dengan besar fungsi partisi kanonik:Mari kita ulang semuanya menggunakan ansambel kanonik besar saat ini. Volume yang tersisa tetap dan tidak mencari di sama sekali dalam perawatan ini. Seperti sebelumnya,j adalah indeks untuk partikel-partikel dari spesies j dan i adalah indeks untuk microstate i:
| Grand potential: |  |
|---|---|
| Internal energy: |  |
| Particle number: |  |
| Entropy: |  |
| Helmholtz free energy: |  |
Kesetaraan antara deskripsi pada batas termodinamika
Semua uraian di atas berbeda dalam cara mereka memungkinkan sistem diberikan kepada berfluktuasi antara konfigurasinya.Dalam ansambel mikro-kanonik, pertukaran sistem ada energi dengan dunia luar, dan karena itu tidak tergantung pada fluktuasi energi; dalam ansambel kanonik, sistem ini bebas untuk bertukar energi dengan luar dalam bentuk panas .
Dalam [batas [termodinamika]], yang merupakan batas dari sistem yang besar, fluktuasi menjadi diabaikan, sehingga semua penjelasan ini bertemu dengan deskripsi yang sama. Dengan kata lain, perilaku makroskopik sistem tidak bergantung pada ansambel khusus digunakan untuk deskripsinya.
Mengingat pertimbangan-pertimbangan ini, ansambel terbaik untuk memilih untuk perhitungan sifat-sifat makroskopik sistem adalah bahwa ansambel yang memungkinkan hasil yang akan diperoleh paling mudah.
Jalan Acak
Kajian tentang polimer rantai panjang telah menjadi sumber masalah dalam dunia mekanika statistik sejak sekitar tahun 1950-an. Salah satu alasan para ilmuwan tertarik dalam penelitian mereka adalah bahwa persamaan yang mengatur perilaku suatu rantai polimer yang independen dari rantai kimia. Terlebih lagi, persamaan yang mengatur ternyata sebuah jalan acak atau jalan difusif dalam ruang. Bahkan, persamaan Schrödinger sendiri merupakan persamaan difusi dalam waktu imajiner,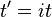 .
.Jalan Acak dalam Waktu
Contoh pertama dari jalan acak adalah sesuatu dalam ruang angkasa, dimana partikel mengalami gerak acak karena kekuatan eksternal dalam medium sekitarnya. Sebuah contoh lain yaitu butiran sari tepung air dalam gelas. Jika seandainya orang bisa “mewarnai” jalan yang telah ditempuh oleh serbuk sari, maka jalan yang tampak adalah suatu jalan yang acak.Mempertimbangkan sebuah masalah kecil, jalan bergerak sepanjang jalur 1D dalam arah x. Misalkan jalan bergerak baik jarak + atau - pada jarak tetap b, tergantung pada sisi koin yang dilempar, apakah muncul kepala atau ekor. Mari kita mulai dengan mempertimbangkan statistik dari langkah jalan kecil yang diambil (dimana
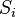 adalah langkah ke-i yang diambil):
adalah langkah ke-i yang diambil): ;karena probabilitas apriori sama
;karena probabilitas apriori sama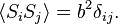
 . Ini masuk akal, karena jika i = j
maka kita mempertimbangkan langkah yang sama. Sebaliknya secara trivial
maka dapat ditunjukkan bahwa perpindahan rata-rata jalan pada sumbu-x
adalah 0;
. Ini masuk akal, karena jika i = j
maka kita mempertimbangkan langkah yang sama. Sebaliknya secara trivial
maka dapat ditunjukkan bahwa perpindahan rata-rata jalan pada sumbu-x
adalah 0;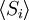 yang dinyatakan adalah 0, maka jumlah dari 0 masih tetap 0. Hal ini
juga dapat ditunjukkan menggunakan metode yang sama seperti yang
ditunjukkan di atas untuk menghitung akar mean nilai kuadrat dari
masalah. Hasil perhitungan ini diberikan di bawah ini:
yang dinyatakan adalah 0, maka jumlah dari 0 masih tetap 0. Hal ini
juga dapat ditunjukkan menggunakan metode yang sama seperti yang
ditunjukkan di atas untuk menghitung akar mean nilai kuadrat dari
masalah. Hasil perhitungan ini diberikan di bawah ini:Jalan Acak dalam Ruang
Jalan acak dalam ruang dapat dianggap sebagai snapshot dari jalan yang diambil oleh alat bantu jalan acak dalam waktu. Salah satu contoh adalah konfigurasi spasial polimer rantai panjang.Ada dua jenis jalan acak dalam ruang : jalan acak self-avoinding, dimana ikatan antar rantai polimer berinteraksi dan tidak tumpang tindih dalam ruang, dan jalan acak pure (murni), di mana ikatan antar rantai polimer tidak berinteraksi dan ikatan terletak bebas di atas satu sama lain. Jenis pertama adalah yang paling digunakan untuk sistem fisik, tapi larutannya sulit untuk dapat menggunakan prinsip pertama.
Dengan mempertimbangkan sebuah hubungan secara bebas, rantai polimer yang tidak berinteraksi, vektor end-to-end adalah
 dimana
dimana  adalah posisi vektor dari ikatan ke-i dalam rantai. Sebagai hasil dari teorema limit pusat, jika N >> 1 kemudian kita anggap distribusi Gaussian untuk vektor end-to-end. Kita dapat membuat pernyataan statistik dari ikatan itu sendiri;
adalah posisi vektor dari ikatan ke-i dalam rantai. Sebagai hasil dari teorema limit pusat, jika N >> 1 kemudian kita anggap distribusi Gaussian untuk vektor end-to-end. Kita dapat membuat pernyataan statistik dari ikatan itu sendiri; ;oleh isotropi ruang
;oleh isotropi ruang ;semua ikatan dalam rantai tersebut tidak berkorelasi satu sama lain
;semua ikatan dalam rantai tersebut tidak berkorelasi satu sama lainMenggunakan statistik dari ikatan individu, maka dengan mudah menunjukkan bahwa
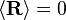 dan
dan  .
Perhatikan hasil terakhir adalah sama dengan yang ditemukan jalan acak
pada waktunya. Dengan asumsi seperti yang telah dinyatakan, bahwa
distribusi vektor end-to-end untuk jumlah yang sangat besar dari rantai
polimer yang identik gaussian, distribusi probabilitas memiliki bentuk
sebagai berikut:
.
Perhatikan hasil terakhir adalah sama dengan yang ditemukan jalan acak
pada waktunya. Dengan asumsi seperti yang telah dinyatakan, bahwa
distribusi vektor end-to-end untuk jumlah yang sangat besar dari rantai
polimer yang identik gaussian, distribusi probabilitas memiliki bentuk
sebagai berikut: .
Secara fisik jumlah ini, microstates yang memiliki vektor end-to-end
dari 0 lebih baik daripada microstate lainnya. Sekarang dengan
mempertimbangkan
.
Secara fisik jumlah ini, microstates yang memiliki vektor end-to-end
dari 0 lebih baik daripada microstate lainnya. Sekarang dengan
mempertimbangkandimana F adalah energi bebas Helmholtz , adalah trivial untuk menunjukkan bahwa
Sebuah pegas hooke!
Hasil ini dikenal sebagai entropic spring result dan jumlah adalah setelah peregangan (stretching) rantai polimer anda melakukan kerja pada sistem untuk menariknya (lebih disukai) dari keadaan kesetimbangannya. Contoh yang umum adalah pita elastis, terdiri dari polimer rantai panjang (karet). Dengan peregangan (stretching) pita elastis anda melakukan kerja pada sistem dan pita berperilaku seperti semi konvensional, kecuali tidak seperti halnya semi logam, semua kerja yang dilakukan muncul sebagai energi termal, banyak dalam kasus termodinamika seperti mengompresi gas ideal dalam piston. Mungkin pada awalnya akan mengejutkan bahwa kerja yang dilakukan pada peregangan (stretching) rantai polimer dapat berhubungan sepenuhnya untuk perubahan entropi dari sistem sebagai akibat dari peregangan (stretching). Namun, ini adalah karakteristik dari sistem yang tidak menyimpan energi apapun sebagai energi potensial, seperti gas ideal. Bahwa sistem tersebut sepenuhnya didorong oleh perubahan entropi pada suhu tertentu, bisa dilihat ketika sebuah kasus yang boleh melakukan kerja pada lingkungan sekitarnya (seperti ketika sebuah pita elastis melakukan kerja pada lingkungan dengan kontraktor, atau gas ideal melakukan kerja pada lingkungan dengan memperluas). Karena perubahan energi bebas dalam kasus tersebut berasal sepenuhnya dari perubahan entropi bukan internal (potensial) konversi energi, dalam kasus kerja, keduanya dapat ditarik seluruhnya dari energi termal dalam polimer, dengan efisiensi 100% dari konversi untuk energi termal untuk kerja . pada gas ideal dan polimer, hal ini dimungkinkan oleh kenaikan bahan entropi dari kontraksi yang membuat hilangnya entropi dari penyerapan energi panas, dan pendinginan material.
Termodinamika Klasik dan Termodinamika Statistika
Sebagai contoh dari sudut pandang termodinamika klasik, orang mungkin bertanya apa itu sebuah sistem termodinamika dari molekul-molekul gas, seperti ammonia NH3 yang menentukan karakteristik energi bebas dari senyawa tersebut? termodinamika klasik tidak memberikan jawaban tersebut. Apabila kita diberikan data spektroskopi dari kumpulan molekul-molekul gas, seperti panjang ikatan, sudut ikatan, rotasi ikatan dan fleksibilitas dari ikatan-ikatan dalam NH3, kita akan melihat bahwa energi bebas tidak lain adalah hal-hal tersebut. Untuk membuktikan kebenaran ini, kita perlu menjembatani pemisah antara bidang mikroskopik dari atom-atom dan molekul-molekul dan bidang makroskopik dari termodinamika klasik. Dari fisika, mekanika statistik menyediakan semacam jembatan dengan mengajarkan kita bagaimana untuk memahami sistem termodinamika sebagai suatu kesatuan dari banyak unit. Secara lebih spesifik hal tersebut menunjukkan bagaimana parameter-parameter termodinamika dari suatu sistem, seperti temperatur dan tekanan dapat diinterpretasikan dalam hubungan parameter-parameter deskriptif dari elemen utama atom-atom dan molekul-molekul.Dalam sebuah sistem yang dibatasi, karakteristik terpenting unit-unit mikroskopik ini yaitu energi-energinya yang terkuantisasi. Hal tersebut dimana energi dapat menjadi sebuah sistem makroskopik membentuk sebuah kontinum virtual dari banyak kemungkinan, energi-energi tersebut terbuka terhadap berbagai komponen-komponen submikroskopik yang terbatas untuk satu set diskontinu dari alternatif yang terhubung dengan nilai-nilai integral dari beberapa bilangan kuantum.
Referensi
- ^ Schrodinger, Erwin (1946). Statistical Thermodynamics. Dover Publications, Inc.. ISBN 0-486-66101-6. OCLC 20056858.
- ^ Srednicki, Mark. "Chaos and Quantum Thermalization." Physical Review E 50 (1994) 888. ArXiv pre-print: cond-mat/9403051
- ^ Srednicki, Mark. "Thermal Fluctuations in Quantized Chaotic Systems." Journal of Physics A29 (1996) L75-L79. ArXiv pre-print: chao-dyn/9511001
- ^ Jarzynski, C. " Berry’s conjecture and information theory." Physical Review E 56, 2254 (1997). ArXiv pre-print: chao-dyn/97030




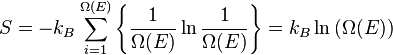








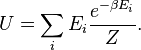


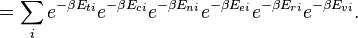
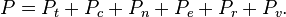
![\Xi(V,T,\mu) = \sum_i \exp\left(\beta \left[\sum_{j=1}^n \mu_j N_{ij}-E_i\right ]\right)](http://upload.wikimedia.org/math/f/a/4/fa4a0a546cb56b26e20a56be1480d439.png)






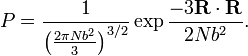




Tidak ada komentar:
Posting Komentar